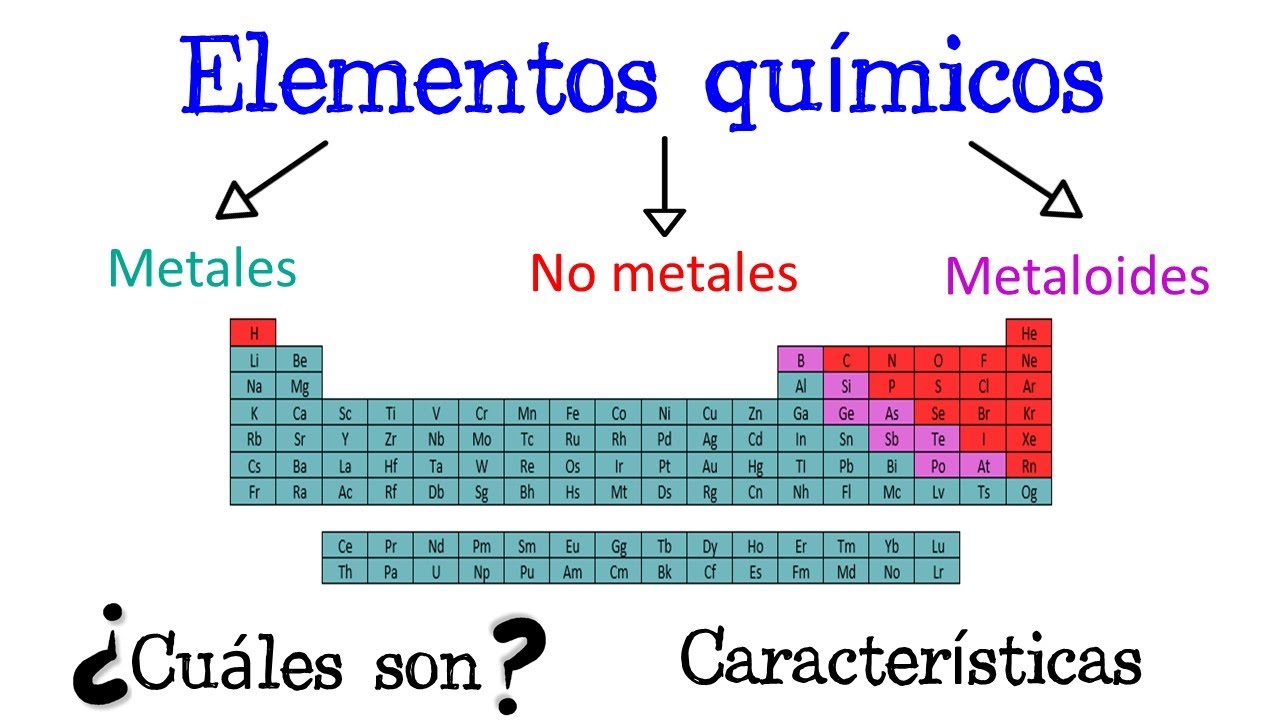
Los elementos químicos se clasifican en metales y no metales, cada uno con propiedades únicas que los distinguen. Comprender la diferencia entre estos dos grupos es esencial para entender su comportamiento en la naturaleza y su aplicación en diversos campos.
Propiedades de los metales
Los metales son conocidos por ser buenos conductores de electricidad y calor debido a la capacidad de sus electrones para moverse con libertad. Esta conductividad los hace ideales para aplicaciones en electrónica y en la industria de la energía. Además, los metales suelen ser maleables y dúctiles, lo que significa que pueden ser martillados en láminas delgadas o estirados en alambres sin romperse.
Maleabilidad y dureza
La maleabilidad de los metales les permite formar diferentes estructuras y componentes sin fracturarse, lo que los hace indispensables en la fabricación de piezas para maquinaria y construcción de edificios. Aunque la mayoría de los metales son duros, algunos pueden ser más blandos y maleables, como el oro y el aluminio, lo que los hace útiles en la joyería y en la fabricación de envases, respectivamente.
Propiedades de los no metales
Los no metales, por otro lado, tienen propiedades opuestas a los metales en muchos aspectos. En general, los no metales son malos conductores de electricidad y calor, lo que los excluye de ciertas aplicaciones industriales. Sin embargo, los no metales son fundamentales en la naturaleza y en la química orgánica, siendo constituyentes esenciales de compuestos como el agua y los carbohidratos.
Electronegatividad y reactividad
Los no metales tienden a ser más electronegativos que los metales, lo que significa que tienen una mayor afinidad por los electrones. Esta propiedad los hace reactivos en combinación con otros elementos, formando enlaces covalentes para completar sus capas de valencia. Elementos como el oxígeno y el nitrógeno son ejemplos de no metales ampliamente utilizados en la biología y la industria química.
Aplicaciones y usos
Tanto los metales como los no metales desempeñan roles fundamentales en nuestra sociedad y en la naturaleza. Los metales son esenciales en la fabricación de maquinaria, construcción, electrónica y transporte, mientras que los no metales son vitales en la química orgánica, la biología y la producción de materiales no conductores.
Equilibrio en la naturaleza
La coexistencia de metales y no metales en la Tierra permite un equilibrio tanto en los ecosistemas como en las actividades humanas. La capacidad de interactuar y combinar estos elementos en diversas formas ha impulsado el progreso tecnológico y científico a lo largo de la historia.
Impacto medioambiental
La extracción y utilización de metales ha tenido un impacto significativo en el medio ambiente, generando desafíos relacionados con la contaminación del aire, agua y suelo. Por otro lado, los no metales, al ser menos utilizados en aplicaciones industriales, tienen un impacto ambiental menor, lo que resalta la importancia de la sostenibilidad en la gestión de recursos naturales.
Innovación y desarrollo sostenible
La búsqueda de alternativas más sostenibles en la industria ha llevado al desarrollo de materiales compuestos que combinan propiedades de metales y no metales para maximizar la eficiencia y minimizar el impacto ambiental. Estas innovaciones demuestran cómo la colaboración entre disciplinas puede conducir a soluciones creativas para los desafíos actuales.
¿Por qué los metales son buenos conductores de electricidad?
Los metales tienen electrones libres que pueden moverse a través del material, permitiendo el transporte de carga eléctrica con facilidad.
¿Cuál es el no metal más abundante en la atmósfera?
El nitrógeno es el no metal más abundante en la atmósfera terrestre, representando aproximadamente el 78% de su composición.
¿Cómo afecta la oxidación a los metales y no metales?
La oxidación puede causar corrosión en metales al formar óxidos en su superficie, mientras que en los no metales puede influir en su estabilidad química y reactividad.